
Karboliinihappo on yksi fenolin nimiä,mikä osoittaa sen erityistä käyttäytymistä kemiallisissa prosesseissa. Tämä aine on kevyempi kuin bentseeni siirtyy nukleofiiliseen substituutioreaktioon. Yhdisteen luontaiset happamat ominaisuudet selitetään vetyatomin liikkumisella renkaaseen sitoutuneeseen hydroksyyliryhmään. Molekyylin rakenteen ja fenolin kvalitatiivisten reaktioiden tutkiminen mahdollistaa aineen luokittelemisen aromaattisina yhdisteinä - bentseenin johdannaisina.
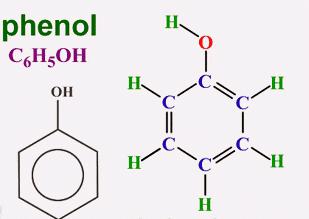
Vuonna 1834 saksalainen kemisti Runge erottiKarboliinihappo kivihiilitervasta, mutta ei kyennyt tulkitsemaan sen koostumusta. Myöhemmin muut tutkijat ehdottivat kaavaa ja antoivat uuden yhdisteen aromaattisille alkoholeille. Tämän ryhmän yksinkertaisin edustaja on fenoli (hydroksibentseeni). Puhtaassa muodossaan tämä aine on läpinäkyvä kide, jolla on tunnusomainen haju. Ilmassa fenolin väri voi muuttua, vaaleanpunainen tai punainen. Aromaattisen alkoholin ominaispiirre on heikko liukoisuus kylmässä vedessä ja hyvä orgaanisissa liuottimissa. Fenoli sulaa lämpötilassa 43 ° C. Se on myrkyllinen yhdiste, kun se pääsee iholle, se aiheuttaa vakavia palovammoja. Molekyylin aromaattista osaa edustaa radikaali fenyyli (C6H5-). Hydroksyyliryhmän (-OH) happi on sitoutunut suoraan yhteen hiiliatomista. Jokaisen partikkelin läsnäolo osoittaa vastaavan kvalitatiivisen reaktion fenoliin. Kaava, joka esittää molekyylin kemiallisten elementtien atomien kokonaispitoisuutta, on C6H6O. Rakenne heijastaa rakenteellisia kaavoja, jotka sisältävät Kekule-syklin ja funktionaalisen ryhmän - hydroksyylin. Aromaattisen alkoholin molekyylin visuaalinen esitys saadaan pallomaisilta malleilta.

Bentseenin ytimen ja OH-ryhmän vuorovaikutusmäärittää fenolin kemialliset reaktiot metallien, halogeenien ja muiden aineiden kanssa. Aromaattisen syklin yhteydessä olevan happiatomin läsnäolo johtaa molekyylin elektronin tiheyden uudelleenjakautumiseen. O-H-sidos muuttuu enemmän polaariseksi, mikä johtaa hydrolyysiryhmän vedyn liikkumisen lisääntymiseen. Protoni voidaan korvata metalliatomilla, mikä ilmaisee fenolin happamuuden. Sen sijaan OH-ryhmä lisää bentseenirenkaan reaktio-ominaisuuksia. Elektronien delokalisoituminen ja kyky elektrofiiliseen substituutioon ytimessä ovat kasvussa. Tämä lisää orto- ja para-asemaan liittyvien vetyatomien liikkuvuutta (2, 4, 6). Tämä vaikutus johtuu sähköisen tiheyden luovuttaja-hydroksyyliryhmän läsnäolosta. Sen vaikutuksesta johtuen fenoli on aktiivisempi kuin bentseeni reaktioina tiettyjen aineiden kanssa ja uudet substituentit suuntautuvat orto- ja para-asemiin.
Hydroksyyliryhmän aromaattisten alkoholien atomihappi saa positiivisen varauksen, heikentää sen sitoutumista vedyllä. Protonin vapautuminen helpottuu, joten fenoli käyttäytyy kuin heikko happo, mutta alkoholit ovat vahvempia. Laadulliset reaktiot fenoliin sisältävät lakmus-testi, joka vaihtaa väriä sinisestä vaaleanpunaiseen protonien läsnäollessa. Bentseenirenkaaseen sitoutuneiden halogeeniatomien tai nitroryhmien läsnäolo johtaa vedyn aktiivisuuden lisääntymiseen. Vaikutusta havaitaan fenolin nitrojohdannaisten molekyyleissä. Pienentää sellaisten substituenttien happamuutta kuin aminoryhmä ja alkyyli (CH3-, C2H5- ja muut). Yhdisteisiin, jotka yhdistävät bentseenirenkaan, hydroksyyliryhmän ja metyyliradikaalin koostumuksessaan, sisältyy kresoli. Sen ominaisuudet ovat heikompi kuin karboliinihappo.

Aromaattiset ominaisuudet siirron vuoksielektronit bentseenin ytimessä. Rengasta tuleva vety korvataan halogeeniatomilla, nitroryhmällä. Vastaava prosessi fenolimolekyylissä on helpompaa kuin bentseenissä. Yksi esimerkki on bromaus. Halogeeni vaikuttaa bentseenissä katalysaattorin, bromibentseenin, läsnä ollessa. Fenoli reagoi bromivedyn kanssa normaaleissa olosuhteissa. Vuorovaikutuksen tuloksena muodostuu 2,4,6-tribromifenolin valkoinen sakka, jonka ulkonäkö mahdollistaa testattavan aineen erottamisen samanlaisista aromaattisista yhdisteistä. Bromaus on kvalitatiivinen reaktio fenoliin. Kaava: C6H5-OH + 3Br2 = C6H2Br3 + HBr. Reaktion toinen tuote on vetybromidi. Kun fenoli reagoi laimealla typpihapolla, saadaan nitro-johdannaisia. Reaktiotuote väkevällä typpihapolla - 2,4,6-trinitrofenolilla tai pikriinihapolla on erittäin käytännöllinen.

Kun aineet ovat vuorovaikutuksessa,tiettyjä tuotteita, joiden avulla voit luoda lähtöaineiden laadullinen koostumus. Useat värireaktiot ilmaisevat hiukkasten, funktionaalisten ryhmien läsnäolon, mikä on sopiva kemialliseen analyysiin. Fenolin kvalitatiiviset reaktiot todistavat aromaattisen renkaan ja OH-ryhmän sisältämän molekyylin läsnäolon:

Fenolin tuotanto teollisuudessa menee kahteentai kolmessa vaiheessa. Ensimmäisessä vaiheessa kumeenia (isopropyylibentseenin triviaali nimi) saadaan propeenista ja bentseenistä alumiinikloridin läsnä ollessa. Friedel-Craftsin reaktioyhtälö on C6H5-OH + C3H6 = C9H12 (kumeeni). Bentseeni ja propyleeni 3: 1 -suhteessa ohjataan happokatalysaattorin päälle. Yhä useammin kuin perinteisen katalysaattorin - alumiinikloridin sijasta - käytetään ympäristöystävällisiä zeoliitteja. Lopullisessa vaiheessa hapetetaan hapella rikkihapon läsnäollessa: C6H5-C3H7 + 02 = C6H5-OH + C3H60. Fenolit voidaan saada kivihiiltä tislaamalla, ovat välituotteita muiden orgaanisten aineiden tuotannossa.
Aromaattisia alkoholeja käytetään laajaltimuovien, väriaineiden, torjunta-aineiden ja muiden aineiden tuotanto. Karboliinihapon tuotanto bentseenistä on ensimmäinen askel useiden polymeerien, myös polykarbonaattien, luomisessa. Fenoli reagoi formaldehydin kanssa, saadaan fenoliformaldehydihartseja.

Sykloheksanoli toimii raaka-aineena vapautumisellepolyamidit. Fenoleja käytetään antisepteinä ja desinfiointiaineina deodoranteissa, voiteissa. Käytetään fenasetiinin, salisyylihapon ja muiden lääkkeiden tuottamiseen. Fenoleja käytetään hartsien valmistuksessa, joita käytetään sähkölaitteissa (kytkimet, pistorasiat). Niitä käytetään myös atsovärejä, esimerkiksi fenyyliamiinia (aniliini) valmistuksessa. Punaviinihappoa, joka on fenolin nitrojohdannainen, käytetään värjäämään kankaita räjähteiden valmistamiseksi.
</ p>>